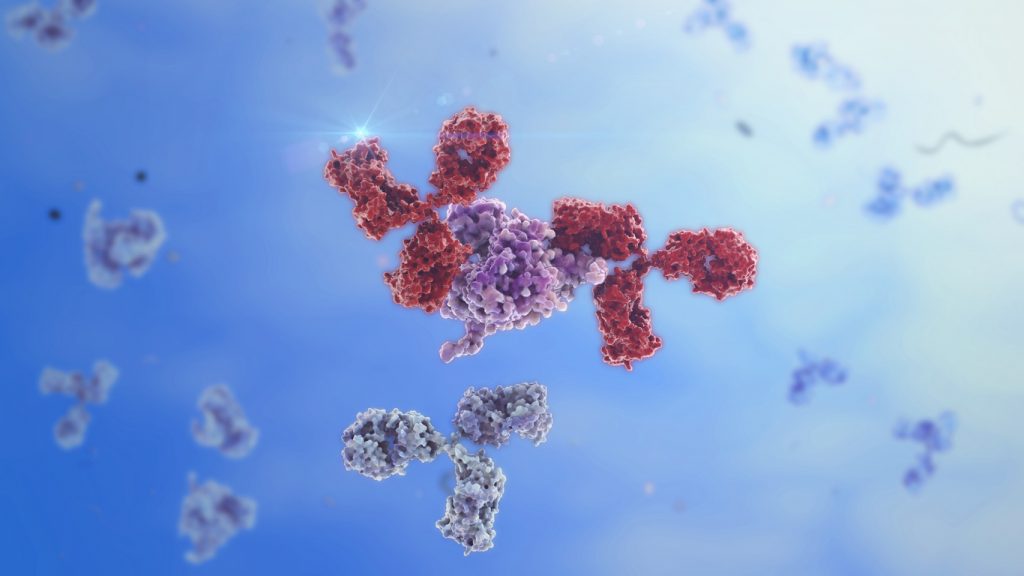
Antikroppar är kroppens superhjältar som känner igen och röjer undan sjukdomsframkallande ämnen. Genom att kombinera delar från antikroppar har forskare vid Lunds universitet designat en hybridantikropp som bättre stimulerar immunförsvaret mot både SARS-CoV-2-virus och streptokockbakterier.
– Hybridantikroppen är betydligt bättre än kroppens egna antikroppar på att bekämpa såväl streptokocker som SARS-CoV-2, säger forskarna bakom upptäckten.
Man kan tänka på antikroppar som nycklar och på antigen som lås. Varje antikropp är formad för att passa ett visst antigen, som en nyckel passar till ett visst lås. Antikroppens unika förmåga att binda till särskilda sjukdomsframkallande protein gör dem lockande för forskare som vill ta fram sjukdomsbehandlingar, genom att bygga vidare på antikropparnas specifika nyckelegenskaper.
De senaste åren har stora framsteg gjorts. Inom vården finns till exempel antikroppsbehandling mot cancer, så kallade checkpointhämmare, där antikroppar tagits fram för att blockera vissa proteiner för att gasa på kroppens möjlighet att bekämpa viss cancersjukdom.
Designar antikroppar
Pontus Nordenfelt och Arman Izadi är forskare vid Lunds universitet och något av antikroppsdesigners. I labbet har de tagit fram antikroppar både mot SARS-CoV-2 och mot streptokockbakterier från patienter som infekterats av dessa sjukdomar. De vill förstå vad det är som gör en antikropp bra, så att den skyddar kroppen ännu bättre.

En av de vanligaste och viktigaste antikropparna är IgG. Den finns i fyra varianter och det är själva stammen (pinnen på Y:et) som avgör vilken undergrupp antikroppen tillhör. Det är också den delen som signalerar till immunförsvaret när den stöter på främmande ämnen. I en studie som i april 2024 publicerades i Nature Communications har forskarna skapat en ny hybridantikropp genom att kombinera delar från två IgG-undergrupper.
– Vill man förstärka antikropparnas funktion är det stammen vi kan manipulera med genteknik, vilket vi gjorde. Därmed har vi fått en antikropp som inte naturligt förekommer i kroppen, säger Arman Izadi, doktorand i infektionsmedicin vid Lunds universitet som under studien bland annat varit verksam som läkare på Skånes universitetssjukhus.
Längden hade betydelse
Den traditionella synen är att ju starkare en antikropp binder till sitt antigen, desto bättre.
– Men trots att vi noterade en 12-faldig försämring i bindningen, så såg vi en femfaldig förbättring vad gäller antikroppens immunaktiverande funktion att få immunceller att äta upp streptokock-bakterier, säger Arman Izadi.
Kan en längre stam på antikroppen göra den mer rörlig och därmed öka dess förmåga att signalera till immunceller att äta upp fler bakterier? För att veta mer exakt vad som händer när antikroppen binder till antigenet måste man studera antikroppen på atomnivå och då krävs särskilda superdatorer. Forskarna har samarbetat med kollegor på bland annat Pasteurinstitutet i Frankrike där en sådan superdator finns.
– Det tog en superdator två månader att på atomnivå se hur antikropparna rör sig i 3D i förhållande till bakteriens antigen, säger Pontus Nordenfelt, som leder forskargruppen.
Genteknik förlängde antikroppens stam
Superdatorn såg samma sak som forskarna hade sett i labbet: den nydesignade IgG-antikroppen band inte lika hårt, men den har en förbättrad funktion. Antikroppen med längre stam var betydligt mer rörlig än den som binder starkare.
– Vi testade därefter vår hypotes om antikroppslängd och funktion genom att med genteknik förlänga i olika längder den ursprungliga undergruppen IgG1 med IgG3:ans stam. Vi såg att den näst längsta hybridversionen hade överlägset bäst funktion av alla antikroppar och intressant nog hade den också stark bindning till antigenet, säger Arman Izadi.
Skyddar möss från sjukdom
Forskarna har även undersökt antikroppen i möss.
– Man ska ha med sig att den djurmodell vi använder inte behöver betyda att det fungerar i människor. Men när vi testar hybridantikroppens förmåga i förhållande till de två andra antikropparna var det bara hybridantikroppen som kan skydda mössen från sjukdom. Vi får det bästa av två världar, både bra bindning och bra immunfunktion som leder till skyddande effekt, säger Pontus Nordenfelt.
Det paradoxala resultatet att en svagare bindning mellan antikropp och antigen kunde medföra en förbättrad funktion har fått forskarna att fundera – är forskarvärlden för fokuserad på att bindningen ska vara stark?
– Vi kanske i stället ska fokusera mer på funktionerna hos antikroppen, även om det är mer komplicerad forskning. Normalt tittar man alltid på bindningen först, men tänk vad många antikroppar man riskerar att gå miste om, om vi ratar dem på grund av att de inte binder så bra?, konstaterar Pontus Nordenfelt.
Länk till vetenskaplig publikation: “The hinge-engineered IgG1-IgG3 hybrid subclass IgGh47 potently enhances Fc-mediated function of anti-streptococcal and SARS-CoV-2 antibodies”
Text: TOVE SMEDS
Artikeln är tidigare publicerad som nyhet från Lunds universitet