Neurologen och forskaren Oskar Hansson har lyckats visa att biomarkörer i ryggvätska kan tidigt sålla fram personer som löper risk att drabbas av Alzheimers. Men för att förstå vad som faktiskt triggar igång sjukdomen och varför hjärnans nervceller börjar dö – och för att i förlängningen hitta bot – behövs ett helhetsgrepp, en kombination av flera olika metoder. Avancerad bildteknik är en viktig pusselbit i hans fortsatta arbete.
Neurologen och forskaren Oskar Hansson har lyckats visa att biomarkörer i ryggvätska kan tidigt sålla fram personer som löper risk att drabbas av Alzheimers. Men för att förstå vad som faktiskt triggar igång sjukdomen och varför hjärnans nervceller börjar dö – och för att i förlängningen hitta bot – behövs ett helhetsgrepp, en kombination av flera olika metoder. Avancerad bildteknik är en viktig pusselbit i hans fortsatta arbete.
Allt började i en frustration över en allvarlig sjukdom som saknar bot men drabbar så många att det nästan börjar ses som en naturlig del av åldrandet. Vi talar om Alzheimers sjukdom. När Oskar Hansson så småningom träffade Lennart Minthon, professorn och överläkaren med demenssjukdomar som specialitet, bestämde de sig för att gemensamt utveckla bättre och mer tillförlitliga metoder för tidig diagnostik av Alzheimers sjukdom.
Idag får knappt hälften av de demensdrabbade rätt diagnos (läs också All glömska är inte demens – men knappt hälften får rätt diagnos), något som är mycket olyckligt eftersom det faktiskt finns mediciner som kan lindra symtomen och som har bäst effekt om de sätts in tidigt.
– Det är inte helt enkelt att ställa en demensdiagnos och även om det görs en demensutredning är det inte alltid så lätt för läkarna på vårdcentralen att tolka svaren, säger Oskar Hansson, överläkare vid Minneskliniken vid Skånes universitetssjukhus och docent vid Lunds universitet.
Proteiner i ryggvätska visar på risk
Han lyckades visa att två biomarkörer*, två proteiner som finns i ryggvätska, kunde kopplas till risken att utveckla Alzheimers sjukdom. Den ena är beta-amyloid som bildar de karakteristiska placken, proteinansamlingar som kan ses i hjärnan hos personer med Alzheimers sjukdom. Det andra proteinet kallas tau och tros ha en koppling till nervcellsdöden.
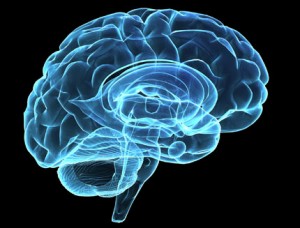
Forskarna kunde visa att personer med lättare minnessvårigheter, men som ännu inte hade fått diagnos, och som samtidigt hade ovanligt låga halter av beta-amyloid och förhöjda halter av tau löpte en hög risk att drabbas av Alzheimers sjukdom inom en överskådlig framtid.I ett nästa steg kunde man visa att de sjukliga förändringarna i beta-amyloid och tau kunde ses så tidigt som tio år innan patienten fick sin Alzheimersdiagnos. Genom att avbilda patienternas hjärnor med s.k. amyloid-PET (se faktaruta) kunde man dessutom visa att det fanns en tydlig koppling mellan stora mängder beta-amyloidplack i hjärnbarken och låga halter av samma protein i ryggvätska. Metoderna bekräftade varandra.
– I ett nästa steg hoppas vi på att kunna göra det möjligt att analysera biomarkörer direkt från blodprov vilket är mycket enklare att ta än ryggvätskeprov. Då skulle provtagningen kunna ske direkt på vårdcentralerna och ge läkarna ytterligare ett verktyg för att kunna ställa rätt diagnos.
Läkemedelstester måste göras tidigare
Biomarkörerna från ryggvätskeprov behövs dessutom som ett vassare verktyg för att kunna ställa en tidig, säker diagnos, t.ex. i samband med läkemedelsprövningar. Läkemedelsindustrin har hittills inte lyckats få fram några lovande läkemedelssubstanser som kan bromsa eller stoppa utvecklingen av Alzheimers sjukdom. Eftersom forskarna nu börjar få bevis på att beta-amyloid börjar ansamlas i hjärnan så tidigt som kanske tjugo år innan symtomen börja ge sig till känna kan det vara så att läkemedlen testats i ett alldeles för sent stadium, då stora delar av hjärnan hunnit bli förstörda.
Nu görs därför nya läkemedelsstudier runt om i världen på patienter i ett tidigare förstadium till sjukdomen. Med hjälp av ryggvätskeprov sållar man ut patienter med endast lättare minnessvårigheter, men som har sjukliga halter av beta-amyloid och tau, och dessa behandlas sedan med de nya läkemedlen.
Hjärnans signaler tar andra vägar
För att studera vad som händer i hjärnan på ett ännu tidigare stadium, kanske innan en person börjar uppleva några symtom, måste biomarkörerna kombineras med avancerad bildteknik, t.ex. funktionell MR (se faktaruta). Med denna teknik kan man bland annat studera hur olika delar av hjärnan kommunicerar med varandra när personer utför vissa uppgifter.
– Vi har kunnat se att individer med amyloidupplagring i hjärnan, men som ännu inte har fått symtom, har sämre aktivering (underaktiveraing) i vissa delar av hjärnan jämfört med individer utan amyloidupplagring. Detta tycks de kompensera genom aktivitet i andra delar av hjärnan. Att studera den här typen av aktivitetsförändringar skulle också kunna användas som ytterligare pusselbit till tidig diagnos.
Vad är hönan och vad är ägget?
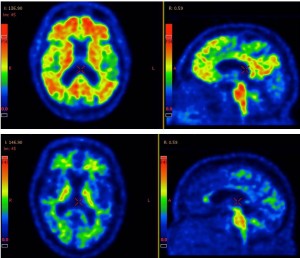
Nyligen fick forskarna ett nytt verktyg som ger dem möjligheten att studera upplagringen i hjärnan av det andra proteinet, tau, som verkar ha en mer direkt koppling till celldöd. Sedan tidigare vet man att beta-amyloid börjar ansamlas väldigt tidigt, 10-20 år innan symtomen kommer. Den ansamlas generellt i hela hjärnbarken men verkar inte ha någon direkt koppling till den celldöd som uppstår betydligt senare och då endast på några specifika ställen i hjärnan.
Med tau-PET (se faktaruta) har man kunnat visa att det istället är proteinet tau, som kommer betydlig senare, som har en mycket starkare koppling i både tid och rum till nervcellernas död. Så är det kanske tau som är boven i dramat och skurken man borde fokusera på?
– Det är nog inte så enkelt, menar Oskar Hansson. Är det tau som orsakar nervcellsdöden eller är det när cellerna börja må riktigt dåligt av all beta-amyloid som tau börjar ansamlas? Kanske är det så att vi behöver gå in och stoppa amyloidinlagringen på ett mycket tidigt stadium, som en kroniskt förebyggande behandling som bör påbörjas redan i medelåldern.
Nya tekniker öppnar nya möjligheter att förstå sjukdomsmekanismen
Den nya tau-PET-tekniken, i kombination med de andra teknikerna som används för att studera Alzheimers sjukdom inom ramen för Biofinderprojektet, öppnar stora möjligheter att studera hur proteinerna beta-amyloid och tau förhåller sig till varandra. Forskarna hoppas få svar på frågor som: I vilket stadium av beta-amyloidinlagringen kommer tau? Vilka sjukliga förändringar relaterade till beta-amyloid krävs för att inlagringen av tau ska komma igång? Vilka processer leder till att nervceller börjar gå under? Hur kan man koppla olika sjukliga förändringar till olika symtom?
Allt detta börjar bli möjligt och förhoppningsvis kan det så småningom leda till att forskarna börjar förstå mekanismen bakom Alzheimers sjukdom och utifrån dessa kunskaper kunna utveckla läkemedel och behandlingar som stoppar den svåra sjukdomen som drabbar så många äldre.
*Biomarkör: en biologisk substans som används för att visa på förekomsten av ett visst ämne eller ett specifikt biologiskt tillstånd.
Text: EVA BARTONEK ROXÅ
Foto: Roger Lundholm (porträtt), Swedish BioFINDER Study (PET-bilder)
Nya artiklar varje dag under temaveckan!
Under temaveckan berättar vi om de senaste framstegen inom demensvård och demensforskning vid Lunds universitet och Skånes universitetssjukhus. Mellan den 9 och 16 mars publicerar vi en ny artikel varje vardag. Länkar till alla artiklarna finns till höger.